Візуалізація з майже 100 тис. зображень, отриманих за допомогою електронного мікроскопа, показала винахідливий спосіб відключення білка міозину для збереження енергії. Він бере участь в м’язовій активності. Подробиці дослідження повідомляє журнал Nature.

Міозин взаємодіє з іншими білками і молекулами для руху людини. Він знаходиться всередині м’язових волокон, де утворює довгі міозинові нитки, що складаються зі сотень окремих молекул білка. Коли м’язова активність припиняється, процес формування міозинових ниток йде в зворотному напрямку: філаменти повертаються в первинний стан молекули міозину.
Візуалізація, розроблена вченими з Університету Лідса у Великобританії і Університету Східної Кароліни в США, показала, як в такому випадку змінюється структура молекули. Вона складається і стає більш компактною.
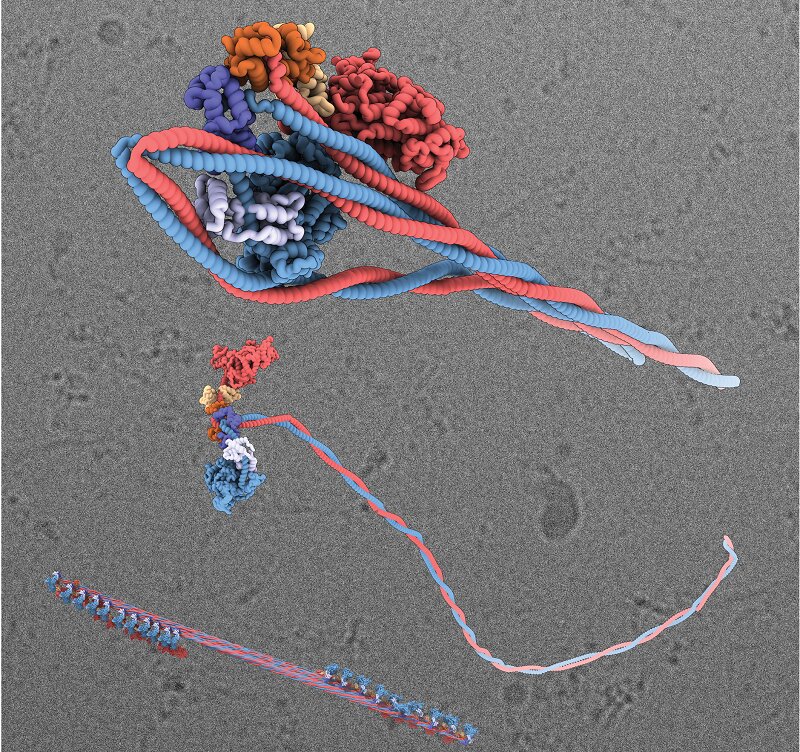
Окрема молекула міозину складається з «голови» і «хвоста». В активному стані хвости молекул об’єднуються, утворюючи волокнисті міозинові нитки. Головки всередині філамента зв’язуються з іншим білком – актином – для скорочення м’язів.
Вивчивши 96 тис. зображень, отриманих за допомогою електронного мікроскопа, вчені побачили, як молекула міозину приймає неактивну форму з безпрецедентною деталізацією. Хвіст кожної молекули обвивається навколо голови і фіксується на місці. Цей процес припиняє активність міозину і спрощує його транспортування в тілі людини.
Вчені десятиліттями знали про роль міозину в м’язовій активності. Але дотепер їм було неясно, як саме він переходив в неактивний стан або як його формування так строго контролювалося.
Натхнення: hightech.fm
